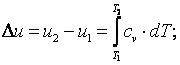
(4.1)
При исследовании термодинамических процессов используются уравнение состояния идеальных газов и математическое выражение первого закона термодинамики.
При изучении термодинамических процессов идеальных газов требуется:
1) определить уравнение кривой процесса в pv-диаграмме;
2) установить связь между термодинамическими параметрами;
3) определить изменение внутренней энергии рабочего тела по формуле, справедливой для всех процессов идеального газа,
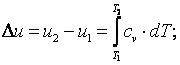
|
(4.1) |
4) определить величину внешней (термодинамической) удельной работы по формуле
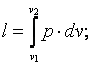
|
(4.2) |
5) определить количество теплоты, участвующей в термодинамическом процессе, по формуле

|
(4.3) |
6) определить изменение энтальпии в термодинамическом процессе по формуле
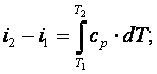
|
(4.4) |
7) определить изменение энтропии в термодинамическом процессе по формуле, справедливой для всех процессов идеального газа,
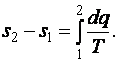
|
(4.5) |
В общем случае любые два термодинамических параметра из трех могут изменяться произвольно. Изучение работы тепловых машин показывает, что наибольший интерес для практики представляют следующие основные процессы: при постоянном объеме (V=const); при постоянном давлении (р=const); при постоянной температуре (Т=const); при dq=0 (процесс, протекающий без теплообмена рабочего тела с окружающей средой); политропный процесс, который при определенных условиях можно рассматривать в качестве обобщающего по отношению ко всем основным процессам.
Чтобы получить обобщенные и простые формулы, уравнения первого закона термодинамики рассматриваются для 1 кг идеального газа.
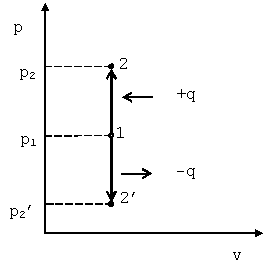
Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис. 4.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условие dv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа (см. &1.6) при v=const. В pv-координатах график процесса представляет собой прямую линию, параллельную оси p. Изохорный процесс может протекать с повышением давления (процесс 1-2) и с понижением (процесс 1-2’).
|
|
Рис. 4.1. График изохорного процесса в p-v координатах
|
Запишем для точек 1 и 2 уравнения состояния: p1·v=R·T1; p2·v=R·T2. Следовательно, для изохорного процесса
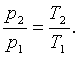
|
(4.6) |
Приращение внутренней энергии газа
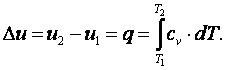
|
(4.7) |
Работа газа
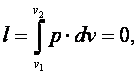
|
Энтальпия газа iv=u+p·v, а div=du+d(p·v)=du+p·dv+v·dp=du+v·dp. Поэтому
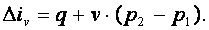
|
(4.8) |
Энтропия 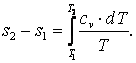
То есть
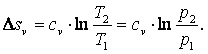
|
(4.9) |
В p-v координатах график процесса представляет собой прямую линию параллельную оси v (рис. 4.2). Изобарный процесс может протекать с увеличением объёма (процесс 1-2) и с уменьшением (процесс 1-2’). Запишем для точек 1 и 2 уравнения состояния: p·v1=R·T1; p·v2=R·T2.
|
|
|
Рис. 4.2. График изобарного процессав p-v координатах
|
Следовательно, для изобарного процесса
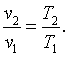
|
(4.10) |
Приращение внутренней энергии газа 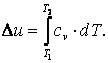 Работа газа
Работа газа 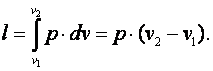 Так как p·v2=R·T2, а p·v1=R·T1, то l=R·(T2-T1). Следовательно, газовая постоянная имеет определённый физический смысл: это работа 1 кг газа в изобарном процессе при изменении температуры на один градус. Из выражения (4.3) следует, что в изобарном процессе q=cp·(T2-T1). В соответствии с первым законом термодинамики для изобарного процесса можно записать dq=du+p·dv= du+d(p·v)=di. Поэтому в изобарном процессе di=q=cp·(T2-T1). Из соотношений, характеризующих изобарный процесс, вытекает известное уравнение Майера. Так как dq=cp·dT=cv·dT+dl=cv·dT+R·dT, то R=cp-cv.
Так как p·v2=R·T2, а p·v1=R·T1, то l=R·(T2-T1). Следовательно, газовая постоянная имеет определённый физический смысл: это работа 1 кг газа в изобарном процессе при изменении температуры на один градус. Из выражения (4.3) следует, что в изобарном процессе q=cp·(T2-T1). В соответствии с первым законом термодинамики для изобарного процесса можно записать dq=du+p·dv= du+d(p·v)=di. Поэтому в изобарном процессе di=q=cp·(T2-T1). Из соотношений, характеризующих изобарный процесс, вытекает известное уравнение Майера. Так как dq=cp·dT=cv·dT+dl=cv·dT+R·dT, то R=cp-cv.
Используя выражение (4.5), можно показать, что в изобарном процессе энтропия газа

|
(4.11) |
|
|
|
Рис. 4.3. График изотермического процесса в p-v координатах
|
В p-v координатах график процесса изображается равнобокой гиперболой (рис. 4.3). Изотермический процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).
Запишем для точек 1 и 2 уравнения состояния p1·v1=R·T; p2·v2=R·T. Следовательно, для изотермического процесса p1·v1=p2·v2=const.
Приращение внутренней энергии газа
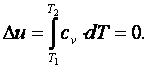
|
Работа газа
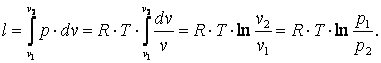
|
(4.12) |
Теплота, подводимая в процессе
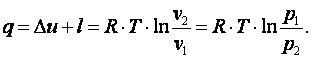
|
(4.13) |
Изменение энтальпии газа Δi=Δu+Δ(p·v)=0.
Изменение энтропии газа
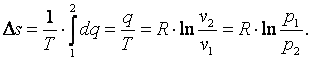
|
(4.14) |
Адиабатный процесс – это процесс, при котором рабочее тело не обменивается теплотой с окружающей средой (dq=0). Для получения графика процесса в p-v координатах выполним некоторые преобразования.
В соответствии с первым законом термодинамики dq=cv·dT+p·dv=c·dT, где с – теплоёмкость термодинамического процесса. Тогда можно записать, что
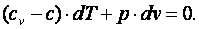
|
(4.15) |
Продифференцируем уравнение состояния идеального газа и запишем

|
(4.16) |
Так как R=cp-cv, то выражение (4.15) можно переписать с учётом (4.16) следующим образом:
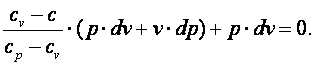
|
(4.17) |
Выполним преобразования выражения (4.17).
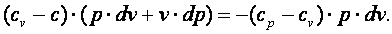
|
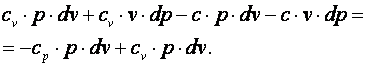
|
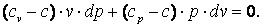
|
(4.18) |
Разделим выражение (4.18) на (cv-c)·p·v и получим:
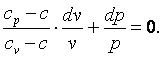
|
(4.19) |
Обозначим 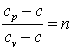 , тогда
, тогда
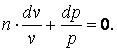
|

|
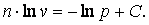
|
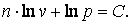
|
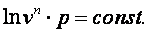
|
Следовательно
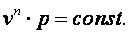
|
(4.20) |
В адиабатном процессе dq=0, то есть c·dT=0. Поэтому c=0. Значит в адиабатном процессе 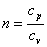 . Эту величину принято обозначать буквой
. Эту величину принято обозначать буквой 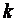 и называть показателем адиабаты.
и называть показателем адиабаты.
Поэтому в p-v координатах адиабатный процесс изображается неравнобокой гиперболой vk·p=const (рис. 4.4). Так как k>1, то адиабата проходит круче гиперболы. Адиабатный процесс может протекать как с увеличением объёма (процесс 1-2), так и с уменьшением объёма (процесс 1-2’).

|
Запишем для точек 1 и 2 уравнения состояния p1·v1=R·T1; p2·v2=R·T2. Так как в адиабатном процессе p1·v1k=p2·v2k, то
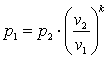 ,
,  ,
,
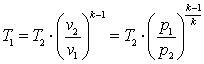 .
.
Приращение внутренней энергии газа 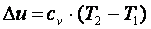 .
.
Так как 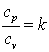 , а
, а 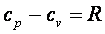 , то
, то 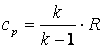 , а
, а 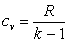 . Поэтому
. Поэтому
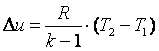
|
(4.21) |
Работа газа в адиабатном процессе выполняется за счёт его внутренней энергии. Так как в адиабатном процессе отсутствует обмен теплотой с окружающей средой, то в соответствии с первым законом термодинамики имеем l+Δu=0 или l=-Δu. Поэтому
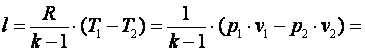
|

|
(4.22) |
Изменение энтальпии газа в адиабатном процессе может быть определено исходя из следующих соображений:
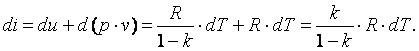
|
Так как 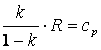 , то в итоге получим
, то в итоге получим
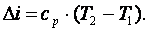
|
(4.23) |
Энтропия газа в адиабатном процессе не изменяется, так как dq=0. Поэтому в T-s координатах адиабатный процесс изображается прямой линией, параллельной оси температур.
Политропным процессом называется любой произвольный процесс изменения состояния рабочего тела, происходящий при постоянной теплоёмкости сп.
В политропном процессе dq=cп·dT.
Для получения графика политропного процесса в p-v координатах будем придерживаться тех же рассуждений, что и при получении графика адиабатного процесса. Заменим в соотношениях, полученных при изучении адиабатного процесса, обозначение теплоёмкости с на сп и обнаружим, что p·vn=const, а 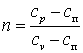 . В дальнейшем всё, что написано об адиабатном процессе, можно распространить на описание политропного процесса, заменяя в выражениях k на n.
. В дальнейшем всё, что написано об адиабатном процессе, можно распространить на описание политропного процесса, заменяя в выражениях k на n.
Покажем, что адиабатный процесс делит все процессы на две группы: на процессы, в которых теплоёмкость больше нуля, и на процессы, в которых теплоёмкость меньше нуля.
Так как 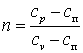 , то можно записать
, то можно записать
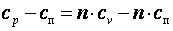 ;
;
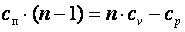 ;
;
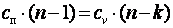 ;
;
 .
.
Из последнего выражения видно, что при n>k cп>0, а при k>n>1 cп<0.
В заключение отметим, что все рассмотренные ранее процессы – это частные случаи политропного процесса.
При n=k имеем адиабатный процесс.
При n=0 имеем р1·v10=р2·v20, то есть изобарный процесс (p1=p2).
При n=1 имеем р1·v1= р2·v2, то есть изотермический процесс.
При n=∞ имеем 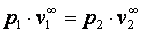 или
или 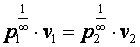 , что равносильно
, что равносильно 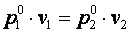 или
или 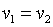 , то есть изохорный процесс.
, то есть изохорный процесс.