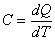 ,
,
(2.1)
Известно, что подвод теплоты к рабочему телу или отвод теплоты от него в каком-либо процессе приводит к изменению его температуры. Отношение количества теплоты, подведенной (или отведенной) в данном процессе, к изменению температуры называется теплоемкостью тела (системы тел):
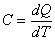 , ,
|
(2.1) |
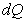 — элементарное количество теплоты;
— элементарное количество теплоты; 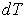 — элементарное изменение температуры.
— элементарное изменение температуры.
Теплоемкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повысить ее температуру на 1 градус. Так как единицей количества теплоты в СИ является джоуль, а температуры — градус К, то единицей теплоемкости будет Дж/К.
В зависимости от внешних условий и характера термодинамического процесса теплота 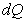 может либо подводиться к рабочему телу, либо отводиться от него. Учитывая, что система участвует в бесчисленном множестве процессов, сопровождающихся теплообменом, величина
может либо подводиться к рабочему телу, либо отводиться от него. Учитывая, что система участвует в бесчисленном множестве процессов, сопровождающихся теплообменом, величина 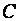 для одного и того же тела может иметь различные значения. В общем случае значение теплоёмкости
для одного и того же тела может иметь различные значения. В общем случае значение теплоёмкости 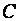 лежит в интервале от -∞ до +∞, то есть она может быть любой положительной или отрицательной величиной.
лежит в интервале от -∞ до +∞, то есть она может быть любой положительной или отрицательной величиной.
Поэтому обычно в выражении (2.1) при теплоёмкости 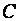 указывается индекс "x", который характеризует вид процесса теплообмена
указывается индекс "x", который характеризует вид процесса теплообмена
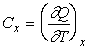 . .
|
(2.2) |
Индекс "x" означает, что процесс подвода (или отвода) теплоты идет при постоянном значении какого-либо из параметров, например, давления 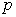 , объема
, объема 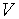 или других.
или других.
Ввиду того, что в термодинамике обычно рассматриваются квазистатические процессы теплообмена, теплоемкость 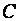 является величиной, относящейся к системе, которая находится в состоянии термодинамического равновесия. Таким образом, теплоемкости являются функциями параметров термодинамической системы. Для простых систем — это функции каких-либо двух из трех параметров:
является величиной, относящейся к системе, которая находится в состоянии термодинамического равновесия. Таким образом, теплоемкости являются функциями параметров термодинамической системы. Для простых систем — это функции каких-либо двух из трех параметров: 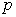 ,
, 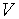 ,
, 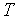 .
.
Опыты показывают, что количество теплоты, подведенное к рабочему телу системы или отведенное от него, всегда пропорционально количеству рабочего тела. Для возможности сравнения вводят, как известно, удельные величины теплоемкости, относя подведенную (или отведенную) теплоту количественно к единице рабочего тела.
В зависимости от количественной единицы тела, к которому подводится теплота в термодинамике, различают массовую, объемную и мольную теплоемкости.
Массовая теплоемкость — это теплоемкость, отнесенная к единице массы рабочего тела,
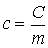 . .
|
Единицей измерения массовой теплоемкости является Дж/(кг • К). Массовую теплоемкость называют также удельной теплоемкостью.
Объемная теплоемкость — теплоемкость, отнесенная к единице объема рабочего тела,
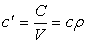 , ,
|
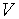 и
и 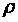 — объем и плотность тела при нормальных физических условиях.
— объем и плотность тела при нормальных физических условиях.
Объемная теплоемкость измеряется в Дж/(м3 • К).
Мольная теплоемкость — теплоемкость, отнесенная к количеству рабочего тела (газа) в молях,
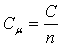 , ,
|
(2.3) |
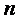 — количество газа в молях.
— количество газа в молях.
Мольную теплоемкость измеряют в Дж/(моль • К).
Массовая и мольная теплоемкости связаны следующим соотношением:
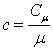
|
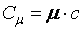 , ,
|
(2.4) |
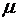 - молекулярная масса.
- молекулярная масса.
Объемная теплоемкость газов выражается через мольную как
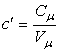
|
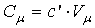 , ,
|
(2.5) |
Учитывая, что теплоемкость непостоянна, а зависит от температуры и других термических параметров, различают истинную и среднюю теплоемкости. Истинная теплоемкость выражается уравнением (2.2) при определенных параметрах термодинамического процесса, то есть в данном состоянии рабочего тела. В частности, если хотят подчеркнуть зависимость теплоёмкости рабочего тела от температуры, то записывают её как 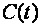 , а удельную – как
, а удельную – как 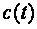 . Обычно под истинной теплоёмкостью понимают отношение элементарного количества теплоты, которое сообщается термодинамической системе в каком-либо процессе к бесконечно малому приращению температуры этой системы, вызванному сообщенной теплотой. Будем считать
. Обычно под истинной теплоёмкостью понимают отношение элементарного количества теплоты, которое сообщается термодинамической системе в каком-либо процессе к бесконечно малому приращению температуры этой системы, вызванному сообщенной теплотой. Будем считать 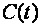 истинной теплоёмкостью термодинамической системы при температуре системы равной
истинной теплоёмкостью термодинамической системы при температуре системы равной 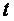 , а
, а 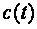 - истинной удельной теплоёмкостью рабочего тела при его температуре равной
- истинной удельной теплоёмкостью рабочего тела при его температуре равной 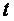 . Тогда среднюю удельную теплоёмкость рабочего тела при изменении его температуры от
. Тогда среднюю удельную теплоёмкость рабочего тела при изменении его температуры от 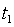 до
до 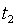 можно определить как
можно определить как
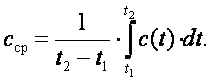
|
(2.6) |
Обычно в таблицах приводятся средние значения теплоемкости 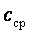 для различных интервалов температур, начинающихся с
для различных интервалов температур, начинающихся с 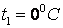 . Поэтому во всех случаях, когда термодинамический процесс проходит в интервале температур от
. Поэтому во всех случаях, когда термодинамический процесс проходит в интервале температур от ![]() до
до 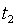 , в котором
, в котором 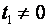 , количество удельной теплоты
, количество удельной теплоты 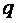 процесса определяется с использованием табличных значений средних теплоемкостей
процесса определяется с использованием табличных значений средних теплоемкостей 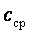 следующим образом:
следующим образом:
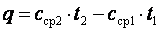 . .
|
(2.7) |
Значения средних теплоемкостей 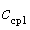 и
и 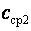 , находят по таблицам.
, находят по таблицам.
Особый интерес представляют средние и истинные теплоемкости в процессах при постоянном объеме 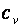 (изохорная теплоемкость, равная отношению удельного количества теплоты в изохорном процессе к изменению температуры рабочего тела dT) и при постоянном давлении
(изохорная теплоемкость, равная отношению удельного количества теплоты в изохорном процессе к изменению температуры рабочего тела dT) и при постоянном давлении 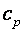 (изобарная теплоемкость, равная отношению удельного количества теплоты в изобарном процессе к изменению температуры рабочего тела dT).
(изобарная теплоемкость, равная отношению удельного количества теплоты в изобарном процессе к изменению температуры рабочего тела dT).
Для идеальных газов связь между изобарной и изохорной теплоёмкостями и устанавливается известным уравнением Майера 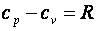 .
.
Из уравнения Майера следует, что изобарная теплоемкость больше изохорной на значение удельной характеристической постоянной идеального газа. Это объясняется тем, что в изохорном процессе (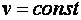 ) внешняя работа не выполняется и теплота расходуется только на изменение внутренней энергии рабочего тела, тогда как в изобарном процессе (
) внешняя работа не выполняется и теплота расходуется только на изменение внутренней энергии рабочего тела, тогда как в изобарном процессе (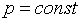 ) теплота расходуется не только на изменение внутренней энергии рабочего тела, зависящей от его температуры, но и на совершение им внешней работы.
) теплота расходуется не только на изменение внутренней энергии рабочего тела, зависящей от его температуры, но и на совершение им внешней работы.
Для реальных газов 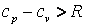 , так как при их расширении и
, так как при их расширении и ![]() совершается работа не только против внешних сил, но и внутренняя работа против сил взаимодействия между молекулами газа, на что дополнительно расходуется теплота.
совершается работа не только против внешних сил, но и внутренняя работа против сил взаимодействия между молекулами газа, на что дополнительно расходуется теплота.
В теплотехнике широко применяется отношение теплоемкостей 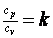 , которое носит название коэффициента Пуассона (показателя адиабаты). В табл. 2.1 приведены значения
, которое носит название коэффициента Пуассона (показателя адиабаты). В табл. 2.1 приведены значения 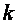 некоторых газов, полученные экспериментально при температуре 15 °С.
некоторых газов, полученные экспериментально при температуре 15 °С.
Таблица 2.1 |
|
Газ |
Показатель адиабаты |
Гелий |
1,660 |
Аргон |
1,667 |
Окись углерода |
1,401 |
Кислород |
1,398 |
Водород |
1,408 |
Азот |
1,41 |
Водяной пар |
1,33 |
Углекислый газ |
1,305 |
Аммиак |
1,313 |
Метан |
1,315 |
Теплоемкости 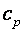 и
и 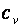 зависят от температуры, следовательно, и показатель адиабаты
зависят от температуры, следовательно, и показатель адиабаты 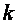 должен зависеть от температуры.
должен зависеть от температуры.
Известно, что с повышением температуры теплоёмкость 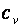 увеличивается. Поэтому с ростом температуры
увеличивается. Поэтому с ростом температуры 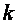 уменьшается, приближаясь к единице. Однако всегда остается больше единицы. Обычно зависимость показателя адиабаты от температуры выражается формулой вида
уменьшается, приближаясь к единице. Однако всегда остается больше единицы. Обычно зависимость показателя адиабаты от температуры выражается формулой вида
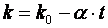 , ,
|
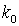 - значение коэффициента при 00 С;
- значение коэффициента при 00 С; 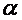 - коэффициент, принимающий для каждого газа своё постоянное значение.
- коэффициент, принимающий для каждого газа своё постоянное значение.
Кроме того, можно установить следующие широко использующиеся зависимости.
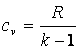 , ,
|
(2.8) |
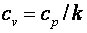
 . .
|
(2.9) |
Данные о теплоёмкостях различных газов приводятся в табличной форме. Обычно в таблицах приводят для различных температур значения мольной истинной и средней теплоёмкости при постоянном давлении и постоянном объёме. Указывают также средние массовые и объёмные теплоёмкости при постоянном объёме и постоянном давлении.
Мольная теплоёмкость указывается в кДж/(кмоль · 0С), массовая – в кДж/(кг · 0С), объёмная – в кДж/(м3 · 0С). При этом значения объёмной теплоёмкости относят к массе газа, заключённой 1 м3 его при нормальных физических условиях.
Для газов, массовая теплоёмкость которых зависит как от температуры, так и от давления, приводят значения удельного объёма и энтальпии 1 кг газа при различных давлениях и температурах. С такого рода зависимостями приходится иметь дело при изучении свойств водяного пара.
Теплоемкость газовой смеси вычисляется по составу газовой смеси и теплоемкостям отдельных газов, входящих в данную газовую смесь. Газовая смесь может быть задана массовым, объемным и молярным составом. Пусть смесь газов задана массовым составом, тогда масса смеси
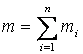 . .
|
(2.10) |
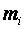 — масса i-го компонента, входящего в смесь.
— масса i-го компонента, входящего в смесь.
Очевидно, для увеличения температуры газовой смеси на 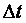 необходимо увеличить температуру на
необходимо увеличить температуру на 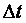 каждого газа этой смеси. При этом на нагревание каждого газа смеси необходимо затратить количество теплоты
каждого газа этой смеси. При этом на нагревание каждого газа смеси необходимо затратить количество теплоты 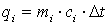 , где
, где 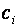 — массовая теплоемкость i-го газа смеси.
— массовая теплоемкость i-го газа смеси.
Теплоемкость газовой смеси определяется из уравнения теплового баланса
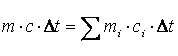 , ,
|
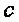 — теплоемкость газовой смеси.
— теплоемкость газовой смеси.
Разделив левую и правую части уравнения на 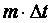 , получим
, получим
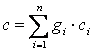 , ,
|
(2.11) |
 — массовая доля i-го газа, входящего в смесь.
— массовая доля i-го газа, входящего в смесь.
Из выражения (2.11) видно, что теплоемкость смеси газов, заданной массовыми долями (массовая теплоемкость смеси), равна сумме произведений массовых долей на массовую теплоемкость каждого газа.
С помощью аналогичных рассуждений можно найти сходные по структуре с полученным выражением выражения для объёмной и мольной теплоёмкостей газовой смеси.